Aproximadamente el 40% del cuerpo es músculo esquelético,
y tal vez otro 10% es músculo liso y cardíaco.
Anatomía fisiológica del músculo esquelético.
Todos los músculos esqueléticos están formados por numerosas fibras cuyo diámetro varía entre 10 y 80 mm.En la mayor parte de los músculos esqueléticos las fibras se
extienden a lo largo de toda la longitud del músculo. Excepto aproximadamente el 2% de las fibras, todas las fibras habitualmente están inervadas sólo por una terminación nerviosa, que está localizada cerca del punto medio de la misma.

El sarcolema es una fina membrana que envuelve a una fibra musculoesquelética. El sarcolema está formado por una membrana celular verdadera, denominada membrana plasmática, y una cubierta externa formada por una capa delgada de material polisacárido que contiene numerosas fibrillas delgadas de colágeno. En cada uno de los
dos extremos de la fibra muscular la capa superficial del sarcolema se fusiona con una fibra tendinosa. Las fibras tendinosas a su vez se agrupan en haces para formar los tendones musculares, que después se insertan en los huesos.
Las miofibrillas están formadas por filamentos de actina y miosina. Cada fibra muscular contiene varios cientos a varios miles de miofibrillas. Cada miofibrilla, está formada
por aproximadamente 1.500 filamentos de miosina y 3.000 filamentos de actina adyacentes entre sí, que son grandes moléculas proteicas polimerizadas responsables de la contracción muscular real. Los filamentos gruesos de los diagramas
son miosina y los filamentos delgados son actina, los filamentos de miosina
y de actina se interdigitan parcialmente y de esta
manera hacen que las miofibrillas tengan bandas claras y
oscuras alternas. Las bandas claras contienen sólo filamentos de actina y se denominan
bandas I porque son isótropas a la luz polarizada. Las bandas oscuras contienen filamentos de miosina, así como los extremos de los filamentos de actina en el punto en el que se superponen con la miosina, y se denominan bandas A porque son anisótropas a la luz polarizada.
La interacción entre estos puentes cruzados y los filamentos de actina produce la contracción, los extremos de los filamentos de actina están unidos al denominado disco Z. El disco Z, que en sí mismo está formado por proteínas filamentosas distintas de los filamentos de actina y miosina, atraviesa las miofibrillas y también pasa desde unas miofibrillas a otras, uniéndolas entre sí a lo largo de toda la longitud de la fibra muscular. Por tanto, toda la fibra muscular tiene bandas claras y oscuras, al igual que las miofibrillas individuales. Estas bandas dan al músculo esquelético y cardíaco su
aspecto estriado. La porción de la miofibrilla (o de la fibra muscular entera)
que está entre dos discos Z sucesivos se denomina sarcómero.
Cuando la fibra muscular está contraída, 5, la longitud del sarcómero es
de aproximadamente 2 um.
Las moléculas filamentosas de titina mantienen en su lugar los filamentos de miosina y actina. La relación de yuxtaposición entre los filamentos de miosina y de actina es difícil de mantener. Esto se consigue con un gran número de moléculas filamentosas de una proteína denominada titina. Cada molécula de titina tiene un
peso molecular de aproximadamente 3 millones, lo que hace
que sea una de las mayores moléculas proteicas del cuerpo.
Además, como es filamentosa, es muy elástica. Estas moléculas
elásticas de titina actúan como armazón que mantiene en
su posición los filamentos de miosina y de actina, de modo que
funcione la maquinaria contráctil del sarcómero. Un extremo
de la molécula de titina es elástico y está unido al disco Z; La otra parte de la
molécula de titina la une al grueso filamento de miosina.
La molécula de titina también parece actuar como molde para
la formación inicial de porciones de los filamentos contráctiles
del sarcómero, especialmente los filamentos de miosina.
Los espacios entre las miofibrillas están llenos de un líquido
intracelular denominado sarcoplasma, que contiene grandes cantidades de potasio, magnesio y fosfato, además de múltiples
enzimas proteicas. También hay muchas mitocondrias
que están dispuestas paralelas a las miofibrillas. Las mitocondrias
proporcionan a las miofibrillas en contracción grandes
cantidades de energía en forma de trifosfato de adenosina
(ATP), que es formado por las mitocondrias.

En el sarcoplasma que rodea a las miofibrillas de todas las fibras
musculares también hay un extenso retículo. denominado
retículo sarcoplásmico. Este retículo tiene una organización
especial que es muy importante para controlar la
contracción muscular. Los tipos de fibras musculares de contracción rápida tienen retículos sarcoplásmicos especialmente extensos.
Mecanismo de deslizamiento de los filamentos
de la contracción muscular.
En el estado relajado, los extremos de los filamentos de actina que se extienden entre dos discos Z sucesivos apenas comienzan a superponerse entre sí. Por el contrario,
en el estado contraído estos filamentos de actina han sido traccionados hacia dentro entre los filamentos de miosina, de modo que sus extremos se superponen entre sí en su máxima extensión. Además, los discos Z han sido traccionados por los filamentos de actina hasta los extremos de los filamentos de miosina. Así, la contracción muscular se produce por un mecanismo de deslizamiento de los filamentos. actina. En condiciones
de reposo estas fuerzas están inactivas, pero cuando un potencial de acción viaja a lo largo de la fibra muscular, esto hace que el retículo sarcoplásmico libere grandes cantidades de iones calcio que rodean rápidamente a las miofibrillas. A su vez, los iones calcio activan las fuerzas de atracción entre los filamentos de miosina y de actina y comienza la contracción. Sin embargo, es necesaria energía para que se realice el proceso contráctil. Esta energía procede de los enlaces de alta energía de la molécula de ATP, que es degradada a difosfato de adenosina (ADP) para liberarla. En las siguientes secciones describimos lo que se sabe sobre los detalles de estos
procesos moleculares de la contracción.

La molécula de miosina está formada por seis cadenas polipeptídicas, dos cadenas pesadas, cada una de las cuales tiene un peso molecular de aproximadamente 200.000,
y cuatro cadenas ligeras, que tienen un peso molecular de aproximadamente 20.000 cada una. Las dos cadenas pesadasse enrollan entre sí en espiral para formar una hélice doble, que se denomina cola de la molécula de miosina. Un extremo de cada una de estas cadenas se pliega bilateralmente para formar una estructura polipeptídica globular denominada cabeza de la miosina. Así, hay dos cabezas libres en un extremo de la
molécula de miosina de doble hélice. Las cuatro cadenas ligeras también forman parte de la cabeza de la miosina, dos en cada cabeza. Estas cadenas ligeras ayudan a controlar la función de la cabeza durante la contracción muscular. El filamento de miosina está formado por 200 o más moléculas individuales de miosina. La longitud total de los filamentos de miosina es uniforme,casi exactamente 1,6 mm. Sin embargo, se debe tener
en cuenta que no hay cabezas de puentes cruzados en el centro
del filamento de miosina en una distancia de aproximadamente
0,2 mm, porque los brazos articulados se separan
desde el centro. Otra característica de la cabeza de la miosina que es esencial para
la contracción muscular es que actúa como una enzima
ATPasa. Como se explica más adelante, esta propiedad permite
que la cabeza escinda el ATP y que utilice la energía
procedente del enlace fosfato de alta energía del ATP para
aportar energía al proceso de la contracción.
Los filamentos de actina están formados por actina,tropomiosina y troponina. El esqueleto del filamento deactina es una molécula de la proteína F-actina bicatenaria. Las dos hebras están enroscadas en una hélice de la misma manera que la molécula de miosina. Cada una de las hebras de la doble hélice de F-actina está formada por moléculas de G-actina polimerizadas, cada una de las cuales tiene un peso molecular de aproximadamente 42.000. A cada una de estas moléculas de G-actina se le une
una molécula de ADP. Cada uno de los filamentos de actina tiene una longitud
de aproximadamente 1 mm. Las bases de los filamentos de actina se anclan fuertemente en los discos Z; los extremos de los filamentos protruyen en ambas direcciones para
situarse en los espacios que hay entre las moléculas de miosina.
El filamento de actina también contiene otra proteína, la tropomiosina. Cada molécula
de tropomiosina tiene un peso molecular de 70.000 y una longitud de 40 nm. Estas moléculas están enrolladas en espiral alrededor de los lados de la hélice de F-actina. En
estado de reposo las moléculas de tropomiosina recubren los puntos activos de las hebras de actina, de modo que no se puede producir atracción entre los filamentos de actina y de miosina para producir la contracción.
Unidas de manera intermitente a lo largo de los lados de las moléculas de tropomiosina hay otras moléculas proteicas denominadas troponina. Se trata de complejos de tres subunidades proteicas unidas entre sí de manera laxa, cada una de las cuales tiene una función específica en el control de la contracción muscular. Una de las subunidades (troponina I) tiene una gran afinidad por la actina, otra (troponina T) por la tropomiosina y la tercera (troponina C) por los iones calcio. Un filamento de actina puro sin la presencia del complejo troponina-tropomiosina (pero en presencia de iones
magnesio y ATP) se une instantánea e intensamente a las cabezas de las moléculas de miosina. Después, si se añade el complejo troponina-tropomiosina al filamento de actina, no se produce la unión entre la miosina y la actina. Por tanto, se piensa que los puntos activos del filamento de actina normal del músculo relajado son inhibidos o cubiertos físicamente por el complejo troponina-tropomiosina.
Cuando se contrae el músculo, se realiza un trabajo y es necesaria energía. Durante el proceso de contracción se escinden grandes cantidades de ATP para formar ADP; cuanto mayor sea la magnitud del trabajo que realiza el músculo, mayor será la cantidad de ATP que se escinde, lo que se denomina efecto Fenn.
Energética de la contracción muscular
Generación de trabajo durante la contracción
muscular
Cuando un músculo se contrae contra una carga realiza un
trabajo. Esto significa que se transfiere energía desde el músculo
hasta la carga externa para levantar un objeto hasta una
mayor altura o para superar la resistencia al movimiento. La energía
necesaria para realizar el trabajo procede de las reacciones
químicas de las células musculares durante la contracción
Fuentes de energía para la contracción muscular.
La mayor parte de esta energía es
necesaria para activar el mecanismo de cremallera mediante
el cual los puentes cruzados tiran de los filamentos de actina,
aunque son necesarias cantidades pequeñas para: 1) bombear
iones calcio desde el sarcoplasma hacia el interior del
retículo sarcoplásmico después de que haya finalizado la contracción
y 2) para bombear iones sodio y potasio a través de
la membrana de la fibra muscular para mantener un entorno
iónico adecuado para la propagación de los potenciales de
acción de la fibra muscular.
La contracción de ATP en la fibra muscular, de aproximadamente
4 milimolar, es suficiente para mantener la contracción
completa durante sólo 1 a 2 s como máximo. El ATP se
escinde para formar ADP, que transfiere la energía de la molécula
de ATP a la maquinaria contráctil de la fibra muscular, el ADP se vuelve a
fosforilar para formar nuevo ATP en otra fracción de segundo,
lo que permite que el músculo mantenga su contracción. Hay
varias fuentes de energía para esta nueva fosforilación.
La primera fuente de energía que se utiliza para reconstituir
el ATP es la sustancia fosfocreatina, que contiene un enlace fosfato
de alta energía similar a los enlaces del ATP. El enlace fosfato
de alta energía de la fosfocreatina tiene una cantidad ligeramente mayor de energía libre que la de cada uno de los enlaces del ATP. Por
tanto, la fosfocreatina se escinde inmediatamente y la energía
que se libera produce el enlace de un nuevo ion fosfato al ADP
para reconstituir el ATP. Sin embargo, la cantidad total de fosfocreatina
en la fibra muscular también es muy pequeña, sólo
aproximadamente cinco veces mayor que la de ATP. Por tanto,
la energía combinada del ATP y de la fosfocreatina almacenados
en el músculo es capaz de producir una contracción muscular
máxima durante sólo 5 a 8 s. La segunda fuente importante de energía, que se utiliza
para reconstituir tanto el ATP como la fosfocreatina, es la
«glucólisis» del glucógeno que se ha almacenado previamente
en las células musculares. La escisión enzimática rápida del
glucógeno en ácido pirúvico y ácido láctico libera energía que
se utiliza para convertir el ADP en ATP; después se puede
utilizar directamente el ATP para aportar energía a la contracción
muscular adicional y también para reconstituir los
almacenes de fosfocreatina.
La importancia de este mecanismo de glucólisis es doble.
Primero, las reacciones glucolíticas se pueden producir incluso
en ausencia de oxígeno, de modo que se puede mantener la
contracción muscular durante muchos segundos y a veces
hasta más de un minuto, aun cuando no se disponga de aporte
de oxígeno desde la sangre. Segundo, la velocidad de formación
de ATP por el proceso glucolítico es aproximadamente
2,5 veces más rápida que la formación de ATP en respuesta
a la reacción de los nutrientes celulares con el oxígeno. Sin
embargo, se acumulan tantos productos finales de la glucólisis
en las células musculares que la glucólisis también pierde
su capacidad de mantener una contracción muscular máxima
después de aproximadamente 1 min. La tercera y última fuente de energía es el metabolismo oxidativo. Esto supone combinar oxígeno con los productos
finales de la glucólisis y con otros diversos nutrientes celulares
para liberar ATP. Más del 95% de toda la energía que
utilizan los músculos para la contracción sostenida a largo
plazo procede de esta fuente. Los nutrientes que se consumen
son carbohidratos, grasas y proteínas. Para una actividad
muscular máxima a muy largo plazo (durante un período
de muchas horas) la mayor parte de la energía procede con
mucho de las grasas, aunque durante períodos de 2 a 4 h
hasta la mitad de la energía puede proceder de los carbohidratos
almacenados.
Características de la contracción de todo el músculo.
Muchas características de la contracción muscular se pueden
demostrar desencadenando espasmos musculares únicos. Esto
se puede conseguir con la excitación eléctrica instantánea del
nervio que inerva un músculo o haciendo pasar un estímulo
eléctrico breve a través del propio músculo, dando lugar a una
única contracción súbita que dura una fracción de segundo.
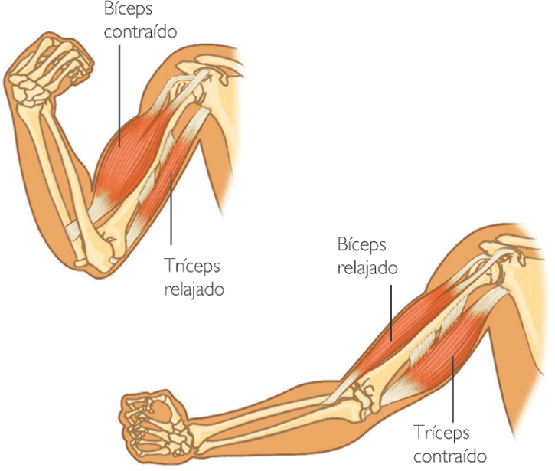
Contracción isométrica frente a isotónica. Se dice que
la contracción muscular es isométrica cuando el músculo no
se acorta durante la contracción e isotónica cuando se acorta,
pero la tensión del músculo permanece constante durante toda
la contracción. En el sistema isométrico, el músculo se contrae contra un
transductor de fuerza sin disminuir la longitud del músculo,. En el sistema
isotónico el músculo se acorta contra una carga fija; esto se
ilustra a la izquierda de la figura, que muestra un músculo que
eleva un platillo de balanza. Las características de la contracción
isotónica dependen de la carga contra la que se contrae el músculo,
así como de la inercia de la carga. Sin embargo, el sistema
isométrico registra estrictamente los cambios de la fuerza de la
propia contracción muscular. Por tanto, el sistema isométrico se
utiliza la mayoría de las veces cuando se comparan las características
funcionales de diferentes tipos de músculo.
Fibras musculares rápidas frente a lentas.
la fisiología de los
deportes, todos los músculos del cuerpo están formados por una
mezcla de las denominadas fibras musculares rápidas y lentas, con
otras fibras intermedias entre estos dos extremos. Los músculos
que reaccionan rápidamente, entre ellos el tibial anterior, están formados
principalmente por fibras «rápidas», y sólo tienen pequeñas
cantidades de la variedad lenta. Por el contrario, los músculos que,
como el sóleo, responden lentamente pero con una contracción
prolongada están formados principalmente por fibras «lentas».
Fibras lentas (tipo I, músculo rojo). 1) Fibras más pequeñas, 2)
también están inervadas por fibras nerviosas más pequeñas,
3) vascularización y capilares más extensos para aportar cantidades
adicionales de oxígeno, 4) números muy elevados de mitocondrias,
también para mantener niveles elevados de metabolismo oxidativo,
y 5) las fibras contienen grandes cantidades de mioglobina,
una proteína que contiene hierro y que es similar a la hemoglobina
de los eritrocitos. La mioglobina se combina con el oxígeno y lo
almacena hasta que sea necesario; esto también acelera mucho el
transporte de oxígeno hacia las mitocondrias. La mioglobina da al
músculo lento un aspecto rojizo y el nombre de músculo rojo.
Fibras rápidas (tipo II, músculo blanco). 1) Fibras grandes
para obtener una gran fuerza de contracción, 2) retículo sarcoplásmico
extenso para una liberación rápida de iones calcio
para iniciar la contracción, 3) grandes cantidades de enzimas
glucolíticas para la liberación rápida de energía por el proceso glucolítico,
4) vascularización menos extensa porque el metabolismo
oxidativo tiene una importancia secundaria, y 5) menos
mitocondrias, también porque el metabolismo oxidativo es secundario. Un déficit de mioglobina roja en el músculo rápido le da el nombre de músculo blanco.

Unidad motora: todas las fibras musculares inervadas por
una única fibra nerviosa. Todas las motoneuronas que salen de
la médula espinal inervan múltiples fibras nerviosas y el número
depende del tipo de músculo. Todas las fibras musculares que
son inervadas por una única fibra nerviosa se denominan unidad
motora. En general, los músculos pequeños que reaccionan
rápidamente y cuyo control debe ser exacto tienen más fibras
nerviosas para menos fibras musculares. Por el contrario, los músculos grandes
que no precisan un control fino, como el músculo sóleo, pueden
tener varios centenares de fibras musculares en una unidad
motora. Una cifra promedio para todos los músculos del cuerpo
es cuestionable, aunque una buena estimación sería de aproximadamente
80 a 100 fibras musculares por unidad motora. Las fibras musculares de todas las unidades motoras no están agrupadas entre sí en el músculo, sino que se superponen a otras unidades motoras en micro fascículos de 3 a 15 fibras. Esta interdigitación
permite que las unidades motoras separadas se contraigan cooperando
entre sí y no como segmentos totalmente individuales.
Contracciones musculares de diferente fuerza: sumación de
fuerzas. Sumación significa la adición de los espasmos individuales
para aumentar la intensidad de la contracción muscular
global. La sumación se produce de dos maneras: 1) aumentando
el número de unidades motoras que se contraen de manera
simultánea, lo que se denomina sumación de fibras múltiples, y
2) aumentando la frecuencia de la contracción, lo que se denomina
sumación de frecuencia y que puede producir tetanización.
Sumación de fibras múltiples.Cuando el sistema nervioso
central envía una señal débil para contraer un músculo, las
unidades motoras más pequeñas del músculo se pueden estimular
con preferencia a las unidades motoras de mayor tamaño.
Después, a medida que aumenta la intensidad de la señal, también
se empiezan a excitar unidades motoras cada vez mayores, de
modo que las unidades motoras de mayor tamaño con frecuencia
tienen una fuerza contráctil hasta 50 veces mayor que las unidades
más pequeñas. Esto se denomina principio de tamaño. Es importante
porque permite que se produzcan gradaciones de la fuerza
muscular durante la contracción débil en escalones pequeños,
mientras que los escalones se hacen cada vez mayores cuando son
necesarias grandes cantidades de fuerza. La causa de este principio
de tamaño es que las unidades motoras más pequeñas son
activadas por fibras nerviosas motoras pequeñas, y que las motoneuronas
pequeñas de la médula espinal son más excitables que
las grandes, de modo que naturalmente se excitan antes.
Sumación de frecuencia y tetanización.
A medida que aumenta la frecuencia,
se llega a un punto en el que cada nueva contracción se produce
antes de que haya finalizado la anterior. En consecuencia,
la segunda contracción se suma parcialmente a la primera, de
modo que la fuerza total de la contracción aumenta progresivamente
al aumentar la frecuencia. Cuando la frecuencia alcanza
un nivel crítico, las contracciones sucesivas finalmente se hacen
tan rápidas que se fusionan entre sí, y la contracción del músculo entero parece ser completamente suave y continua, como
se muestra en la figura. Esto se denomina tetanización.
Máxima fuerza de contracción. La máxima fuerza de contracción
tetánica de un músculo que funciona a una longitud muscular
normal es en promedio de entre 3 y 4 kg por centímetro cuadrado de
músculo.
Cambios de la fuerza muscular al inicio de la contracción: el
efecto de la escalera (Treppe). Cuando un músculo comienza a
contraerse después de un período de reposo prolongado, su fuerza
de contracción inicial puede ser tan pequeña como la mitad de su
fuerza entre 10 y 50 contracciones musculares después. Es decir,
la fuerza de la contracción aumenta hasta una meseta, un fenómeno
que se denomina efecto de la escalera o Treppe.
Tono del músculo esquelético.Incluso cuando los músculos
están en reposo habitualmente hay una cierta cantidad de tensión,
que se denomina tono muscular. Como las fibras normales
del músculo esquelético no se contraen sin que ningún potencial
de acción estimule las fibras, el tono del músculo esquelético
se debe totalmente a impulsos nerviosos de baja frecuencia que
proceden de la médula espinal. Estos, a su vez, están controlados
en parte por señales que se transmiten desde el encéfalo a las
motoneuronas adecuadas del asta anterior de la médula espinal
y en parte por señales que se originan en los husos musculares
que están localizados en el propio músculo.

Fatiga muscular. La contracción prolongada e intensa de un
músculo da lugar al conocido estado de fatiga muscular. Estudios
en atletas han mostrado que la fatiga muscular aumenta en una
proporción casi directa a la velocidad de depleción del glucógeno
del músculo. Por tanto, la fatiga se debe principalmente a
la incapacidad de los procesos contráctiles y metabólicos de las fibras musculares de continuar generando el mismo trabajo. Sin embargo, los experimentos también han mostrado que la transmisión de la señal nerviosa a través de la unión neuromuscular,, puede disminuir al menos un poco después de una actividad muscular prolongada e intensa, reduciendo aún más la contracción muscular. La interrupción del
flujo sanguíneo a través de un músculo que se está contrayendo
da lugar a una fatiga muscular casi completa en un plazo de 1 a
2 min debido a la pérdida de aporte de nutrientes, especialmente
la pérdida de oxígeno.

Sistemas de palanca del cuerpo. Los músculos actúan
aplicando una tensión a sus puntos de inserción en los huesos,
y los huesos a su vez forman varios tipos de sistemas de
palanca.
En breve, el análisis de los sistemas de palanca del cuerpo
depende del conocimiento de: 1) el punto de la inserción muscular;
2) su distancia desde el fulcro de la palanca; 3) la longitud
del brazo de la palanca, y 4) la posición de la palanca. En
el cuerpo son necesarios muchos tipos de movimiento, algunos
de los cuales precisan una intensidad grande, y otros precisan
grandes distancias de movimiento. Por este motivo hay muchos
tipos diferentes de músculo; algunos son largos y se contraen
una distancia larga, y algunos son cortos pero tienen áreas transversales
grandes y pueden proporcionar una fuerza de contracción
extrema en distancias pequeñas. El estudio de los diferentes
tipos de músculos, de los sistemas de palanca y de sus movimientos
se denomina cinesiología y es un componente científico
importante de la fisioanatomía humana.

Recuérdese que un músculo alargado
se contrae con más fuerza que un músculo acortado, Por tanto, el músculo alargado de un lado de una articulación se puede contraer con una fuerza mucho mayor que
el músculo más corto del lado opuesto.
Remodelado del músculo para adaptarse a la función.
Todos los músculos del cuerpo se modelan continuamente para
adaptarse a las funciones que deben realizar. Se altera su diámetro,
su longitud, su fuerza y su vascularización, e incluso se alteran,
al menos ligeramente, los tipos de fibras musculares. Este
proceso de remodelado con frecuencia es bastante rápido, y se
produce en un plazo de pocas semanas. De hecho, experimentos
en animales han demostrado que las proteínas contráctiles del
músculo de algunos músculos de menor tamaño y más activos
se pueden sustituir en tan sólo 2 semanas.
Hipertrofia y atrofia muscular. Cuando se produce un
aumento de la masa total de un músculo se denomina hipertrofia
muscular. Cuando disminuye, el proceso se denomina atrofia
muscular.
Prácticamente toda la hipertrofia muscular se debe a un
aumento del número de filamentos de actina y miosina en cada
fibra muscular, dando lugar a aumento de tamaño de las fibras
musculares individuales; esto se denomina hipertrofia de las fibras.
La hipertrofia aparece en un grado mucho mayor cuando el músculo
está sometido a carga durante el proceso contráctil. Sólo son
necesarias unas pocas contracciones intensas cada día para producir
una hipertrofia significativa en un plazo de 6 a 10 semanas.
Junto con el aumento de tamaño de las miofibrillas, también
se produce un aumento de los sistemas enzimáticos que proporcionan
energía. Esto se aplica especialmente a las enzimas de la
glucólisis, lo que permite el aporte rápido de energía durante
la contracción muscular intensa a corto plazo.
Cuando un músculo no se utiliza durante muchas semanas, la velocidad de degradación de las proteínas contráctiles es mucho más rápida que la velocidad de sustitución. Por tanto, se produce atrofia muscular. La ruta que parece importar en buena parte
para la degradación proteica en un músculo que experimenta
atrofia es la ruta de ubicuitina-proteasoma dependiente del ATP.
Los proteasomas son grandes complejos proteicos que degradan
las proteínas dañadas o innecesarias por proteólisis, una reacción
química que rompe los enlaces peptídicos. La ubicuitina es una
proteína reguladora que básicamente marca las células que serán
diana para una degradación proteasómica.
Ajuste de la longitud muscular. Otro tipo de hipertrofia
se produce cuando los músculos son distendidos hasta
una longitud mayor de lo normal. Esto hace que se añadan
nuevos sarcómeros en los extremos de las fibras musculares,
donde se unen a los tendones. De hecho, se pueden añadir
nuevos sarcómeros con tanta rapidez como varios por
minuto en el músculo en formación, lo que ilustra la rapidez
de este tipo de hipertrofia.
Hiperplasia de las fibras musculares. En situaciones
poco frecuentes de generación extrema de fuerza muscular
se ha observado que hay un aumento real del número de
fibras musculares (aunque sólo en algunos puntos porcentuales),
además del proceso de hipertrofia de las fibras. Este
aumento del número de fibras se denomina hiperplasia de
las fibras. Cuando aparece, el mecanismo es la división lineal
de fibras que estaban previamente aumentadas de tamaño.

Efectos de la denervación muscular. Cuando un músculo
pierde su inervación, ya no recibe las señales contráctiles
que son necesarias para mantener el tamaño muscular
normal. Por tanto, la atrofia comienza casi inmediatamente.
Después de aproximadamente 2 meses también comienzan a
aparecer cambios degenerativos en las propias fibras musculares.
En la fase final de la atrofia por denervación, la mayor
parte de las fibras musculares son destruidas y sustituidas
por tejido fibroso y adiposo. Las fibras que permanecen están
formadas por una membrana celular larga con los núcleos de
las células musculares alineados, pero con propiedades contráctiles
escasas o nulas y con una capacidad escasa o nula de
regeneración de las miofibrillas si vuelve a crecer un nervio.
El tejido fibroso que sustituye a las fibras musculares
durante la atrofia por denervación también tiende a seguir
acortándose durante muchos meses, lo que se denomina contractura.
Por tanto, uno de los problemas más importantes en
la práctica de la fisioterapia es evitar que los músculos que se
están atrofiando presenten contracturas debilitantes y desfigurantes.
Esto se consigue mediante la distensión diaria de los
músculos o la utilización de dispositivos para mantener
los músculos distendidos durante el proceso de atrofia